Certainement l’une des techniques les plus représentatives de la cuisine moléculaire, la gélification est un procédé majeur de cette discipline, également utilisé en cuisine traditionnelle. En quelques mots, il permet de transformer un liquide en gel.
Comment caractériser un gel ?
Les gels, d’apparence visqueuse, sont des liquides emprisonnés dans une structure solide. Ils sont formés de deux milieux dispersés l’un dans l’autre : un premier "solide" constitué de molécules connectées entre elles par des points de réticulation [1] pour former un réseau tridimensionnel (3D), et un second "liquide", composé de molécules indépendantes.
Comment la transition liquide-gel se fait-elle ?
On appelle transition sol-gel le changement d’état d’un système qui passe d’une phase liquide, le sol [2], à une "biphase" sol-gel. Cette transformation se fait en plusieurs étapes :
– Afin d’obtenir un gel, ce sol doit contenir comme particules des molécules à l’origine des monomères [3] qui vont former des polymères [4], en réagissant avec d’autres monomères et se lier entre eux. Ces macromolécules [5] se retrouvent indépendantes entre elles et bien solubilisées dans le solvant - plus les polymères sont ramifiés, plus ils y sont solubles.
– Les polymères créés se regroupent en chaînes polymériques.
– Les molécules d’eau viennent alors se fixer sur ces chaînes, qui se déroulent progressivement du fait de leur zone hydrophile et hydrophobe. Ces molécules présentent en effet une "tête" hydrophile, attirant et se liant à l’eau et au contraire, une "queue" hydrophobe. Elles vont donc s’organiser naturellement de manière à enfermer les molécules d’eau dans le solvant.
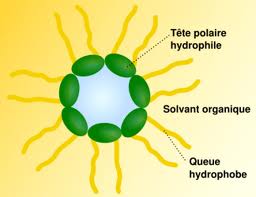
– Les macromolécules se lient enfin par des liaisons chimiques faibles ou fortes et forment un réseau tridimensionnel, emprisonnant dans ses mailles, le solvant.
Le gel est formé.
Les gels sont-ils tous identiques ?
Les liaisons intermoléculaires, assurant la cohésion de ces gels, permettent d’en distinguer deux types : les gels physiques et les gels chimiques. Cette classification s’appuie sur les différents phénomènes de formation du gel, et ainsi de réticulation, qui va lier entre eux les polymères alors indépendants jusqu’à former un réseau tridimensionnel plus ou moins résistant, selon les types d’interactions qui les lient.
– Chez les gels chimiques, les monomères vont former des polymères par réticulation chimique. Ils sont associés entre eux par des liaisons covalentes créées au niveau de points de réticulation de forte énergie. Le réseau alors formé possède une très grande stabilité et ne peut être détruit ni par la température, ni par l’agitation, ni par le pH. Cette formation de gel est ainsi irréversible.
– Chez les gels physiques, au contraire, ce sont des liaisons de faible énergie - des forces de Van der Walls ou des liaisons hydrogènes - qui forment le réseau. Pour liquéfier ces gels, qui sont dit réversibles, il suffit de modifier leurs conditions physico-chimiques. Le remplacer dans ses conditions physiques initiales permet également de reformer le gel.
L’exemple de l’agar-agar ?
Différents additifs alimentaires sont utilisés afin de mener à bien une gélification. Le plus répandu et celui que nous avons utilisé dans notre expérience est l’agar-agar, un gélifiant presque incolore et sans goût qui se retrouve dans l’agroalimentaire sous le code E406.
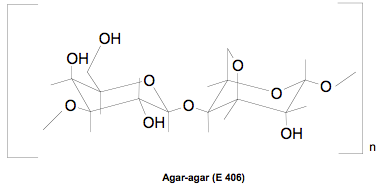
L’agar-agar est un hydrocolloïde, c’est-a-dire une substance qui se transforme en gel au contact de l’eau. Le gel d’agar-agar s’apparente aux gels physiques :
– Sa formule brute est [C12H18O9]n.
– Il est thermoréversible [6] et entame sa gélification à environ 85°C.
– Il est influencé par le pH.
– Il est cassant, mais aussi assez déformable et peu compressible, suivant sa concentration dans le gel.
– Il est composé de molécules d’agarose et d’agaropectine : les premières sont responsables de l’action gélifiante de l’agar-agar.
– Son ajout dans la solution doit être contrôlé ; une quantité trop importante crée un excès de jonctions et entraîne la formation d’agrégats [7] qui donnent un gel rigide non-utilisable.
| Agarose | Agaropectine |
|---|---|
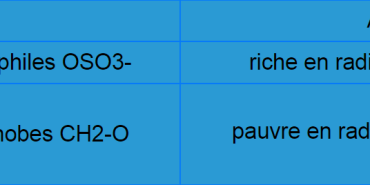
| pauvre en radicaux hydrophiles OSO3- | riche en radicaux hydrophiles OSO3- |
| riche en radicaux hydrophobes CH2-O | pauvres en radicaux hydrophobes CH2-O |
L’agarose rend l’agar-agar gélifiant grâce à ces nombreux groupements hydrophobes CH2-O. Il est également pauvre en groupements organosulfates hydrophiles OSO3- ; contrairement à l’agaropectine qui contient de nombreux groupements polaires et riches en OSO3-.
Lorsque l’agar-agar est mis au contact d’eau et de chaleur, ses radicaux hydrophobes vont en fait tenter de s’isoler de l’eau. Pour cela, les polymères d’agarose principalement, A et B sur le schéma, vont se placer parallèlement de façon à ce que chacun des radicaux hydrophobes, les points rouges, se tournent vers l’intérieur de la molécule, tandis que les radicaux hydrophiles, les points violets, vont se tourner vers l’extérieur. L’eau entre les molécules est progressivement chassée, les deux polymères se rapprochent, tandis que les liaisons hydrogène, de faible intensité, se multiplient et vont former des jonctions : des points de réticulation.

Mais cela ne peut avoir lieu que lorsque la solution est chauffée à une température supérieure à 85°C. Lors du refroidissement jusqu’à ce que la température de la solution atteigne les 40°C, le nombre de liaisons hydrogènes augmente, permettant aux polymères, qui composent l’agar agar (agarose et agaropectine), de s’enrouler entre eux. Il se forme alors un groupement de polymères à doubles hélices, un réseau tridimensionnel, emprisonnant l’eau en grande quantité et permettant à la solution liquide de base de se gélifier !